- 주경준 기자/ 승인 2023-03-15 07:15

최초의 광역학치료제로 피부에 적용되는 항암제 1호 후보물질인 ‘하이브라이트'(HyBryte/synthetic hyperlysine)가 FDA 승인에 다시 도전하기 위해 FDA에 회의를 요청했다.
솔리제닉스는 지난 2월 FDA로부터 서신(RTF) 제출 거부를 받은 하이브라이트에 대해 추가 논의를 위해 Tape-A 회의를 요청했다고 9일 밝혔다. 적응증은 희귀암인 조기 피부T세포림프종(CTLC)이다.
Tape A 회의는 중단되거나 중단된 신약 개발을 지원하기 위해 열리는 회의로 거부된 Hybright 승인 요청을 제출하기 위한 회의입니다.
하이브라이트는 연고 형태의 항암제로 미지의 영역인 미지의 영역에 쉽게 적용할 수 있는 First-in-Class 광역학 항암제입니다. 연고를 바르고 빛(가시광선)에 노출되면 약효가 활성화되어 피부 깊숙이 침투해 암세포를 죽인다.
특정 성분은 아니지만 항우울제에 사용되는 감광성 물질인 하이퍼리신으로 암 주변 활성산소의 산화를 증가시켜 암세포 증식을 억제하는 방법이다.
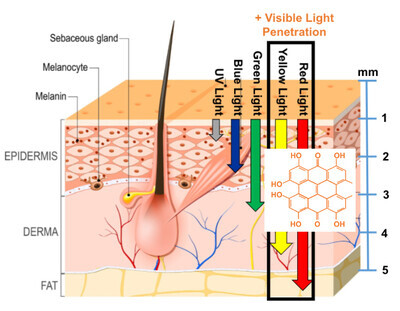
출처 : Soligenix / 사진 편집 뉴스 The Voice
솔리제닉스는 FLASH 임상 3상(NCT02448381)으로 그 효과가 충분히 검증됐다고 평가해 FDA 승인 신청을 했으나 신청 자체가 거부됐다.
임상 결과를 간략히 살펴보면 총 169명의 IA기, IB기 또는 IIA기 CTCL 환자가 참여했습니다. 이 중 116명의 환자가 하이브라이트 치료를 받았고 이 중 50명은 위약군에 속했다.
1차 종점은 피부 병변(3개 병변)이 치료 6주 후 8주에 50% 이상 해결된 환자의 비율이었습니다. 116명의 환자 중 19명(16.4%)이 위약군에서 2명(4%)과 비교하여 기준을 충족했습니다.
2차 평가변수는 치료반응률로 하이브라이트군(110명) 44명(40%)이 6주+2주 휴식의 2주기 완료 후 16주에 반응했고 위약군 2명(4%)이 반응했다. 그룹은 반응했다.
3주기 요법에서는 위약군에서도 하이브리드 요법이 허용되었고 평가 가능한 환자 78명 중 38명(48.7%)이 반응을 보였다. 또한 추가적인 피부 병변인 플라그 감소 효과도 확인됐다.
그러나 상당한 치료 효과가 있다는 홍보에도 불구하고 FDA가 신청을 거부한 이유는 공개되지 않았지만 몇 가지 추측할 수 있는 부분이 있다.
발표된 대표적인 임상 결과에 따르면 장기 추적 관찰 후 완전 관해된 환자의 수는 전혀 나와 있지 않다.
두 번째 부작용 발생률은 16%였으며, 1차 종료점을 충족한 환자 비율도 마찬가지였습니다. 그들 중 대부분은 경미했고 단지 4%만이 중증이었고 단지 2.48%(4명의 환자)만이 심각한 부작용(SAE)으로 설명했습니다. 전체 임상 데이터도 고려하면, 적용 부위의 통증과 같은 특정 부작용은 치료 주기가 증가함에 따라 누적됩니다.
Soligenix는 FDA의 재승인을 구하고 설득하기 위한 자세한 임상 결과를 공유하지 않지만, 어떤 추가 임상 정보를 생성했는지에 대해서는 구체적으로 공개된 바가 없습니다. 6개월의 짧은 추적 관찰 결과 국소치료제인 만큼 안전성이 높다는 점을 강조했다.
FDA, 최초 적용 암 치료제 재제출 회의 요청 거부 – News The Voice Healthcare (newsthevoice.com)
![[남성스킨케어]전신에 도포 가능한 알로에 슬라이딩 젤 추천 '디아마스 알로에 슬라이딩 젤' [남성스킨케어]전신에 도포 가능한 알로에 슬라이딩 젤 추천 '디아마스 알로에 슬라이딩 젤'](https://www.naturecollection.com/upload/product/202201/AF014566_01_1.jpg)
